|
全球首个免疫疗法 阿斯利康Imfinzi再获积极生存数据近日,阿斯利康及旗下全球生物制剂研发部门MedImmune在第19届世界肺癌大会上公布了PD-L1肿瘤免疫疗法Imfinzi的III期临床研究PACIFIC的更新数据。
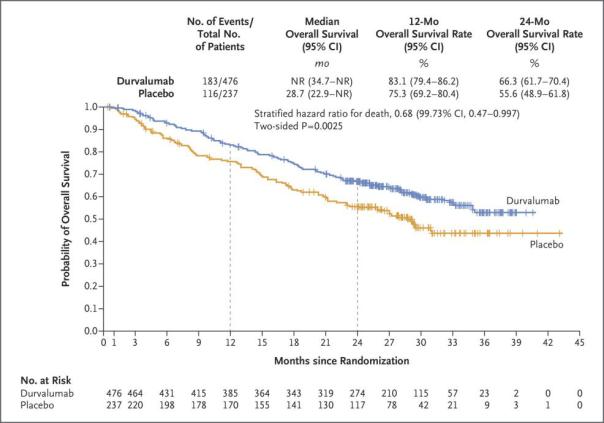
该研究是一项随机、双盲、安慰剂对照、多中心研究,评估了Imfinzi用于治疗接受含铂化疗和放疗(CRT)后病情没有进展的不可切除性、III期(局部晚期)非小细胞肺癌(NSCLC)“all-comer”患者(例如,不论PD-L1状态如何)的疗效和安全性。该研究在26个国家的235个医疗中心开展,涉及713例患者。研究的主要终点是无进展生存期(PFS)和总生存期(OS),次要终点包括标志性PFS和OS、客观缓解率、缓解持续时间等。(所谓的“all comer”患者,是指符合研究协议的所有患者,而不是严格挑选的患者,更加贴近真实世界的临床实践模式,其结果也更具有普遍性。) 在首次中期分析时,与安慰剂相比,Imfinzi使患者PFS显著延长了11.2个月(中位PFS:16.8个月[95%CI:13.0-18.1] vs 5.6个月[95%CI:4.6-7.8];疾病进展或死亡风险风分层HR=0.52,95%CI:0.42-0.65,p<0.001)。 此外,PFS、其他有意义的次要疗效终点(包括发生远端转移或死亡、新发病灶、第二次病情进展或死亡[PFS2]时间、总缓解率)及安全终点的最新结果: 1)OS:与安慰剂,Imfinzi显著延长了OS、使死亡风险显著降低了32%(分层的死亡风险比=0.68,95%CI:0.47-0.997,p=0.0025)。在横跨所有预先指定的患者亚组中,均观察到了Imfinzi的总生存受益,包括基于人口学特征、基线临床病例特征、对先前治疗的反应等等。具体数据为,12个月总生存率方面,Imfinzi治疗组为83.1%(95%CI:79.4-86.2),安慰剂组为75.3%(95%CI:69.2-80.4)。24个月总生存率方面Imfinzi治疗组为66.3%(95%CI:61.7-70.4),安慰剂组为55.6%(95%CI:48.9-61.8)数据具有统计学显著差异(双臂p=0.005)。
OS数据分析结果 2)更新的PFS数据:与安慰剂相比,Imfinzi使患者PFS显著延长了11.6个月(中位PFS:17.2个月[95%CI:13.1-23.9] vs 5.6个月[95%CI:4.6-7.7];分层的疾病进展或死亡风险比HR=0.51,95%CI:0.41-0.63,p<0.001)。 3)死亡或远端转移:与安慰剂组相比,Imfinzi治疗组死亡或远端转移时间延长(中位数:28.3个月[95%CI:24.0-34.9] vs 16.2个月[95%CI:12.5-21.1],分层风险比=0.53[95%CI:0.41-0.68])。 4)新病灶的出现频率:Imfinzi治疗组为22.5%,安慰剂组为33.8%;此外,Imfinzi治疗组新发脑转移发生率低于安慰剂组(6.3% vs 11.8%)。 5)PFS2方面:此外,与安慰剂组相比,Imfinzi治疗组PFS2时间延长(中位PFS2:28.3个月[25.1-34.7] vs 17.1个月[95%CI:14.5-20.7],分层风险比=0.58[95%CI:0.46-0.73])。第一次后续治疗或死亡事件以及第二次后续治疗或死亡时间方面Imfinzi治疗组也比安慰剂组长。 6)总缓解率:Imfinzi治疗组为30.0%(95%CI:25.8-34.5),安慰剂组为17.8%(95%CI:13.0-23.6),数据具有统计学显著差异(p<0.001)。中位缓解持续时间方面,Imfinzi治疗组尚未达到(95%CI:27.4-NR),安慰剂组为18.4个月(95%CI:6.7-24.5)。病情实现缓解的患者中,Imfinzi治疗组有73.5%的患者在第18个月时仍然持续缓解,安慰剂组比例为52.2%。 7)安全性:至新的数据截止日期为止,Imfinzi治疗组和安慰剂组的安全性概况与之前的报告中一致。 阿斯利康全球药物开发执行副总裁兼首席医疗官Sean Bohen表示,这些数据证实了Imfinzi作为首个肿瘤免疫疗法治疗接受化疗后的不可切除性III期NSCLC患者的总生存受益。在临床治疗方面,该类患者在过去几十年来的生存率一直没什么起色,接受化疗后的5年生存率仅为15%。今天公布的显著生存受益数据为患者带来了新的希望,同时提供了信心和明确的理由,Imfinzi将成为这类患者临床治疗的新护理标准。 Imfinzi:全球首个III期不可切除性NSCLC的肿瘤免疫疗法,年销或40亿美元 基于该研究的首次中期分析数据,Imfinzi之前已获美国、加拿大、瑞士、印度、日本、巴西批准,并于近日获得欧盟批准,成为这些国家和地区首个也是唯一一个获批治疗局部晚期(III期)、不可切除性NSCLC的肿瘤免疫疗法,具体用于接受含铂化疗和放疗联合治疗病情没有改善的患者。此外,Imfinzi也已获美国、加拿大、巴西、以色列、中国香港、印度批准,用于治疗晚期或转移性尿路上皮癌(mUC)。 此次公布的OS数据对阿斯利康至关重要。根据该公司2018Q2报告,Imfinzi在Q2的销售额仅为1.22亿美元。有分析师认为,此次III期不可切除性NSCLC的OS数据,将大幅提振Imfinzi的销售额,其2023年的全球销售额有望达到40亿美元。
III期(局部晚期)NSCLC通常分为3个亚类(IIIA,IIIB,IIIC),由肿瘤在局部扩散的程度和手术的可能性来定义。III期不同于IV期,后者是癌症已扩散(转移)到远处器官,而目前III期的治疗目的是治愈。 据估计,III期NSCLC约占NSCLC发病率的三分之一,在2017年约影响全球8大国家(中国、法国、德国、意大利、日本、西班牙、英国、美国)约10.5万人口。III期NSCLC患者中大部分被确诊为不可切除性肿瘤。过去几十年来,在临床治疗方面,除了标准的治疗方案即化-放疗后进行主动监测以监视病情进展,除此之外没有新的治疗方法。但这一疾病的预后并不理想,长期生存率也很低。 Imfinzi(durvalumab)是一种PD-L1肿瘤免疫疗法,靶向结合细胞程序性死亡因子配体1(PD-L1),阻断PD-L1与PD-1和CD80的相互作用,对抗肿瘤的免疫逃避策略并释放对免疫应答的抑制作用。目前,阿斯利康正在开展一个大型临床项目,其中一部分研究正在评估Imfinzi作为单药疗法以及联合化疗、放疗、小分子药物和抗CTLA4单克隆抗体(tremelimumab),作为一线或二线治疗药物,用于NSCLC、小细胞肺癌(SCLC)、局部晚期或转移性尿路上皮癌、头颈癌及其他实体肿瘤的治疗。 |